As bases no nosso dia-a-dia
Algumas bases são encontradas nas substâncias usadas em nosso cotidiano:
- hidróxido de magnésio (Mg(OH)2), presente no leite de magnésia utilizado para combater a acidez estomacal;
- cal hidratada (Ca(OH)2), usada como argamassa na construção civil;
- hidróxido de sódio (NaOH), utilizado para a limpeza de materiais, no desentupimento de canos e largamente empregado na indústria;
- hidróxido de amônio (NH4OH), componente de vários produtos de limpeza vendidos no comércio.
Os indicadores ácido-base e o pH
Algumas substâncias apresentam comportamento distintos na presença de ácidos ou de bases. Entre elas, há um grupo de substâncias que assume diferentes colorações em função de o meio em que se encontram ser ácido ou básico. As substâncias pertencentes a esse grupo são chamadas indicadores ácido-base.
Há uma escala numérica denominada pH, com valores entre 0 e 14, que indica se o meio á ácido, básico ou neutro.
Os valores de pH são calculados matematicamente considerando as concentrações de H-e (OH) presentes em uma solução. O pH significa potencial hidrogeniônico. Quanto menor o valor do pH maior a acidez. Em contrapartida, quando maior o valor do pH, maior a basicidade. É comum, em substituição ao termo basicidade, ser utilizado o termo alcalinidade.
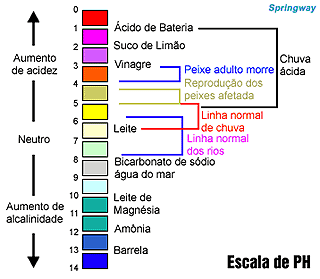
Os indicadores são substâncias que mudam de cor em função do valor do pH, podendo, assim, servir como parâmetro para indicar em que a faixa de pH uma determinada amostra se encontra. Por exemplo, a fenoftaleína é um indicador que, em meio ácido ou neutro, apresenta-se incolor; quando em meio básico, torna-se avermelhada.
Os indicadores não informam o valor exato do pH de uma solução, apenas fornecem dados para avaliar se o meio encontra-se ácido, básico ou neutro. Para saber o valor exato do pH, utiliza-se um equipamento especial, o pHmetro (peagâmetro).

É possível misturar ácidos com bases até conseguir um pH neutro. Esse processo chama-se neutralização e consistem em um tipo de reação química.





























